国家生物信息中心合作研究揭示甲基转移酶SETD2在人巨核细胞发育和血小板生成中的重要作用
巨核细胞(Megakaryocyte,MK)是骨髓中产生血小板的血细胞,血小板在止血、伤口愈合以及炎症反应中具有重要的作用。然而目前血小板输注完全依赖于健康供者捐献,随着血小板输注需求量的增加,供者来源短缺,血小板难以在体外长期保存,血小板的输注存在巨大的供应缺口。而巨核细胞的多倍体化对于血小板产生非常重要,是高效生成功能性血小板的重要保障。因此解析巨核细胞多倍体化调控机制对于突破血小板再生技术瓶颈具有重要意义。
3月25日,国家生物信息中心王前飞团队与美国犹他大学Matthew T. Rondina教授合作在Journal of Thrombosis and Haemostasis 杂志在线发表了题为“SETD2 Promotes Megakaryocyte Polyploidization and Platelet Generation through Methylation of α-tubulin”的研究论文,揭示了SETD2作为全新的调控因子,通过对骨架蛋白甲基化修饰介导巨核细胞的核分裂,从而调控巨核细胞的多倍体化以及血小板产生,为血小板再生提供了新的靶点。
表观因子SETD2在造血谱系发育以及疾病发生中起着重要的调控作用,SETD2的缺失或突变会导致红系、髓系和淋系等多个谱系的发育障碍以及促进白血病的发生。然而,Setd2敲除小鼠中,血小板数量的增加引起了研究团队的注意。研究团队利用基因敲除小鼠模型以及人源巨核细胞诱导分化体系,揭示了Setd2缺失促进骨髓中高倍体巨核细胞的产生,进而促进血小板生成,且血小板的大小、形态和功能均保持正常。团队进一步证明了SETD2是巨核细胞多倍体化的重要负调控因子;并利用特殊定制的微管蛋白三甲基化修饰抗体结合免疫荧光技术,揭示了SETD2通过对微管蛋白α-tubulin的甲基化修饰(α-TubK40me3)调控巨核细胞多倍体化过程中染色体分离的核分裂过程,进而促进巨核细胞的多倍体化及后续的血小板产生。接着,研究人员对SETD2是否可以作为潜在的再生靶点进行了探索。利用人的体外干细胞-巨核细胞分化体系,研究团队发现SETD2小分子抑制剂EZM0414可以使功能性血小板的数量增加3-4倍,证明了SETD2可作为促进体外巨核细胞/血小板再生的一个潜在新靶点。
综上,该研究首次揭示了表观因子SETD2 在巨核谱系发育和血小板再生中的新作用,填补了目前在巨核细胞多倍体化过程中核分裂失败调控的知识空白,同时为巨核细胞发育、血小板相关疾病的治疗和药物开发以及血小板再生等临床问题提供了新的思路。
国家生物信息中心李玥莹研究员、王前飞研究员和美国犹他大学Matthew T. Rondina教授为本文的共同通讯作者。国家生物信息中心博士生陈蕾、刘景坤为本文的共同第一作者。北京大学人民医院张晓辉主任,中国科学院分子细胞科学卓越创新中心邹卫国研究员,国家生物信息中心张昭军副研究员对本项研究提供了重要的材料和工作支持。研究工作得到了国家自然科学基金、北京市杰出青年科学基金、中科院青促会优秀会员项目等支持。
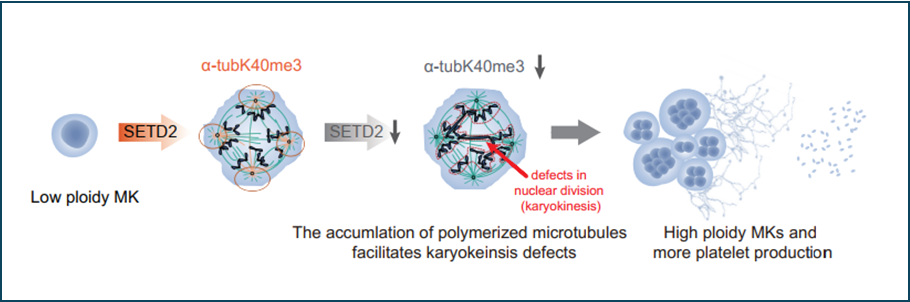
SETD2 通过细胞骨架甲基化修饰调控巨核细胞核分裂失败,进而促进巨核细胞多倍体化以及血小板生成






