国家生物信息中心合作开发房颤新型多遗传因素综合风险评估模型
心房颤动(AF)作为临床上最常见的心律失常,其早期识别与精准风险评估一直是心血管疾病防控的重点与难点。房颤是最常见的心律失常之一,显著增加卒中、心力衰竭及过早死亡风险,房颤患者发生卒中风险高达70%。过去数十年中,全基因组关联分析已识别出数百个位于基因调控区与房颤独立相关的常见变异位点,基因编码区的罕见功能缺失性变异也与早发性房颤密切相关。近年来,体细胞突变,特别是不确定潜能克隆性造血(CHIP)突变也被发现与房颤风险存在显著关联,进一步丰富了房颤的遗传学研究维度。然而,常见、罕见与体细胞变异如何共同作用于房颤风险,以及如何系统整合这些分散信息构建具有临床实用性的房颤风险预测模型,尚未有系统研究。
为此,国家生物信息中心汪敏先研究组与麻省总医院Akl C. Fahed研究组展开合作研究,招募30,797名房颤患者,首次系统性地整合了常见调控变异、罕见基因变异与体细胞突变三大遗传因素,成功构建了一个能够显著提升心房颤动风险预测准确性的综合风险模型(IGM-AF)。研究揭示了这三种遗传成分在房颤发生中的独立与协同作用,为房颤的早期筛查与精准预防提供了重要科学依据。相关成果于2025年10月8日发表于《美国医学会杂志·心脏病学》(JAMA Cardiology)。
研究人员利用英国生物样本库中416,085名参与者的全基因组数据,构建了包含以下三大遗传驱动因素的IGM-AF模型:多基因风险评分(PRS),反映全基因组常见调控变异的累积效应;罕见变异基因集(AFgeneset),包括21个已知与房颤相关基因(如TTN、KDM5B等)的罕见、功能丧失型突变;体细胞CHIP变异,与TET2、ASXL1等7个基因的变异有关。
研究人员通过Cox比例风险模型评估了各遗传因素对未来5年房颤发病率的影响,并将IGM-AF与临床常用的基于临床危险因素的CHARGE-AF评分系统相结合,评估其在房颤风险预测中的表现。
研究发现,PRS、AFgeneset和CHIP均与房颤风险显著相关:PRS高1个标准差时,风险增加65%;携带AFgeneset罕见变异者风险增加63%;携带CHIP变异者风险增加26%。更重要的是,三者之间存在显著的协同效应,在最高风险组中5年发病率可达4.7%,而最低风险组仅为0.6%,相差近8倍。
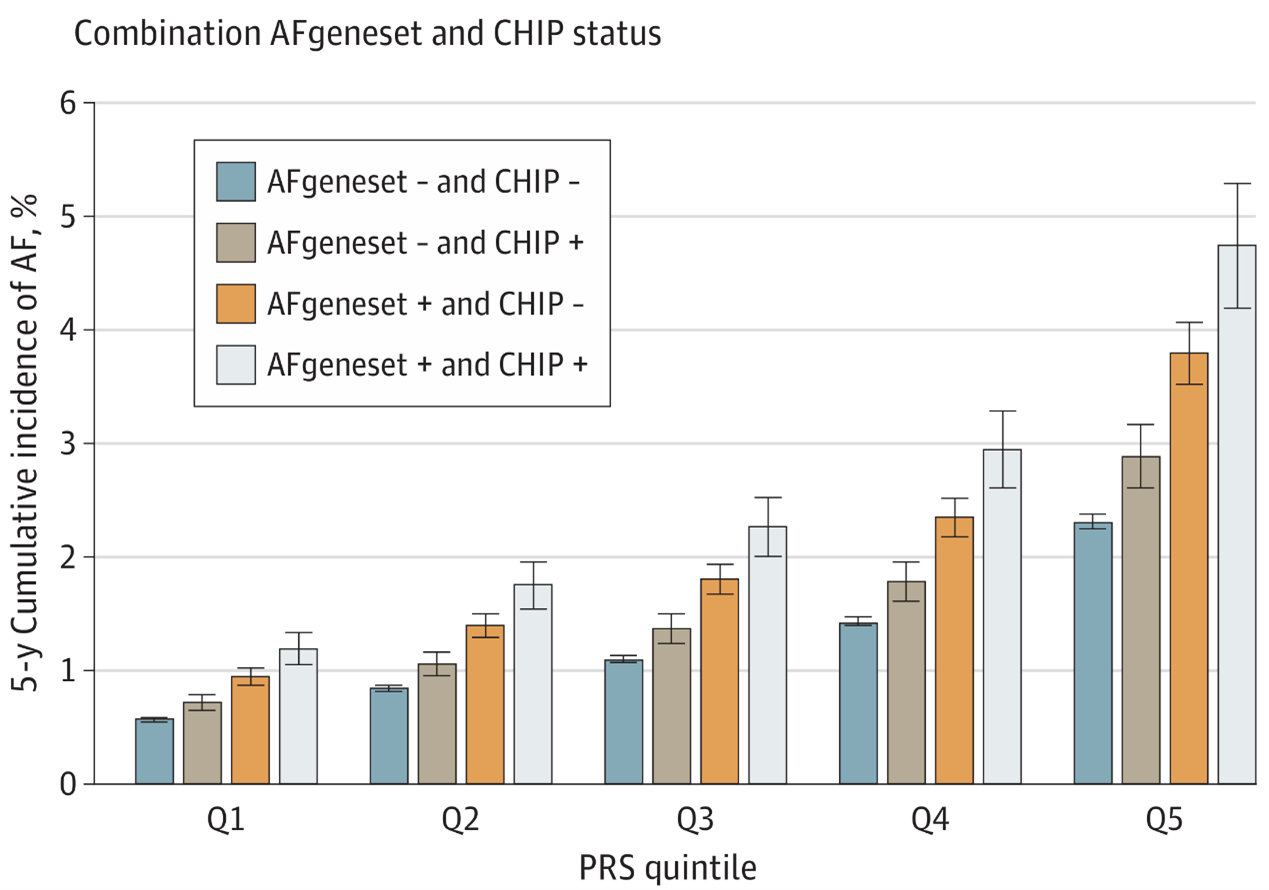
遗传风险叠加显著提高房颤发病率
将IGM-AF与CHARGE-AF临床风险模型结合后,预测效能显著提升。CHARGE-AF单独C统计量为0.77,IGM-AF单独C统计量为0.77,而两者结合后C统计量提升至0.80。此外,加入IGM-AF后,NRI提高0.08,表明该模型能更准确地将个体归类至相应的风险层级。
该研究首次系统揭示了常见、罕见与体细胞遗传变异在房颤风险中的独立与协同作用,成功构建了具有高预测效能的综合基因组模型。该模型与临床风险因素的结合,显著提升了房颤的风险分层能力,为未来实现房颤的精准预防与早期干预提供了强有力的科学工具。研究团队未来将在更多人群中验证IGM-AF模型,进一步探索其临床应用潜力。
该研究由国家生物信息中心、美国博德研究所(Broad Institute of MIT and Harvard)、麻省总医院(Massachusetts General Hospital)和哈佛大学医学院(Harvard Medical School)等机构共同合作完成。国家生物信息中心前博士后张茹帆博士与麻省总医院的Min Seo Kim博士为并列第一作者,国家生物信息中心汪敏先研究员和博德研究所Akl C. Fahed教授为共同通讯作者。






